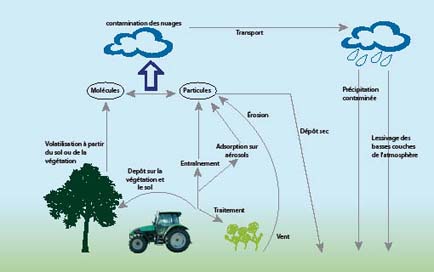
Concernant la collecte des données toxicologiques permettant de déterminer les effets des nanomatériaux sur la santé et l’environnement, des travaux sont en cours pour vérifier la pertinence des tests habituellement menés sur les substances chimiques. En effet, la détection et le dosage spécifique des nanomatériaux nécessitent des outils spécifiques qui tous ne sont pas encore harmonisés ou développés. Cette collecte de données, sans parler de la préparation des échantillons pour mener les tests, dépend étroitement de la collaboration des milieux industriels et de la recherche.
Exposition de la population et atteinte à l’environnement
|
| Les programmes français De nombreux travaux de recherche en France dans le domaine des nanosciences et nanotechnologies s’appuient sur le réseau des centrales technologiques. Ils sont également menés dans le cadre des programmes soutenus par l’ANR et dans les pôles de compétitivité. L’ANR soutient plusieurs programmes : – le programme P3N (programme national en nanosciences et nanotechnologies) subventionne des projets de recherche fondamentale et appliquée, nanocomposants, micro-nanosystèmes, nanobiotechnologies, nanomatériaux, instrumentation et métrologie, modélisation et simulation. Un volet est dédié à l’impact et aux risques des nanotechnologies pour la santé et l’environnement ainsi qu’aux aspects éthiques et sociétaux. À titre d’exemples : – Aquanano (2007), transfert de nanoparticules manufacturées dans les aquifères : développement d’une méthodologie et identification des processus ; – Nanobench (2007), Assessing the S&T economic and social impact of nanotechnologies ; – le programme matériaux et procédés vise la recherche de nouveaux matériaux et de procédés industriels, l’amélioration de leurs performances techniques et économiques et encourage le transfert de technologie vers l’industrie. Les nanomatériaux occupent donc une bonne place dans ce programme ; – le programme SEST (santé environnement et santé travail) a pour but de révéler l’impact, encore peu connu, des facteurs environnementaux sur la santé humaine, en mesurant l’exposition à ces facteurs et en identifiant leur rôle dans l’origine ou l’aggravation de certaines maladies. Ce programme s’intéresse en particulier à l’éventuelle toxicité des nanoparticules. À titre d’exemples, les programmes suivants peuvent être cités : – Nanofeu (2007), impact des nanocharges sur le comportement au feu ; – Signanotox (2007), signatures toxicologiques de nano-objets manufacturés sur des cellules humaines après inhalation ou ingestion ; |
|
PRECISION : Nanogenotox
À signaler, dans le programme européen de santé publique 2008-2013, une action conjointe publiée en février 2009 sur la sécurité des nanomatériaux sous présidence française de l’Union européenne en décembre 2008. La France a assuré la coordination de cette action, qui a fait l’objet d’un appel d’offres, et a présenté un dossier pour un programme dénommé Nanogenetox visant à établir une méthodologie robuste relative à la détection de molécules potentiellement génotoxiques, c’est-à-dire pouvant compromettre l’intégrité du génome. Quinze nanoparticules déjà sur le marché et utilisées dans divers produits (silice, dioxyde de titane et nanotubes de carbone) vont être soigneusement caractérisées au plan physique et chimique et faire l’objet de tests. Cette action, sur trois ans, regroupe 17 institutions et 13 États membres.
|
EXPLICATION |
|
|
PRECISION
L’Afsset soutient, depuis 2004, plusieurs programmes en santé environnement. En 2007 : - impact sur cellules rénales des nanoparticules manufacturées ; - devenir des nanoparticules minérales manufacturées dans les milieux aquatiques. En 2006 : - Nanop : niveaux, déterminants et variabilités des nanoparticules dans l’environnement intérieur ; - évaluation in vitro de la réactivité des particules fines et ultrafines. En 2004 : - toxicité respiratoire des nanotubes de carbone (université catholique de Louvain).
|
EXPLICATION : Les fullerènes et l’eau |
Trois voies d’exposition : respiratoire, à travers la peau et orale
La voie respiratoire constitue la voie d’entrée privilégiée des nanoparticules en raison de leur taille. Les quelques données disponibles jusqu’ici montrent qu’elles se répartissent dans les voies respiratoires en fonction de leur diamètre. Toutefois, l’appareil respiratoire semble présenter une barrière efficace et le passage des nanoparticules entre les poumons et le sang serait limité. On l’estime, à partir de données expérimentales chez l’animal, à environ 1 % des nanoparticules inhalées. Le dépôt des nanoparticules peut se produire à tous les niveaux de l’appareil respiratoire depuis le nez jusqu’aux alvéoles.
La présence de nanoparticules dans de nombreux produits cosmétiques ou paramédicaux amène à s’interroger sur l’exposition à travers la peau. Aujourd’hui, il semble que la peau intacte constitue une barrière efficace : les particules ne passeraient pas la couche cornée de l’épiderme, même si une accumulation dans les follicules pileux (qui produisent les poils) est observée. L’exposition au travers d’une peau lésée n’a pas encore été étudiée avec précision. Toutefois, selon la lésion, les nanoparticules sont susceptibles de pénétrer dans l’organisme via le derme et le réseau des veinules (vaisseaux sanguins de la peau) qu’il contient ainsi que les terminaisons nerveuses.
L’exposition par ingestion de nanoparticules peut se produire en mangeant des aliments contaminés, en avalant des particules inhalées ou en portant à la bouche une main contaminée. L’évaluation de l’exposition est limitée par l’absence de méthodes validées et applicables en routine permettant la détection, l’identification et la quantification des nanoparticules dans la matrice alimentaire.
Le comportement des nanoparticules dans l’eau est très important pour apprécier leur toxicité. Elles peuvent avoir, par rapport à leurs homologues microscopiques, une moindre capacité à se dissoudre et une plus grande tendance à s’agglomérer lorsqu’on les disperse.
Il est important de préciser que les nanoparticules se présentent rarement sous une forme unitaire mais le plus souvent sous la forme d’un agglomérat ou d’un agrégat de nanoparticules, d’une taille, par conséquent, supérieure à celle de la nanoparticule elle-même. Il ne faut néanmoins pas négliger la possibilité que ces agglomérats-agrégats se décomposent lorsqu’ils pénètrent dans l’organisme et que des nanoparticules unitaires passent ainsi l’ensemble des barrières. Par ailleurs, les nanoparticules en agrégats conservent leurs propriétés spécifiques.
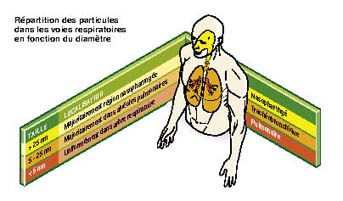
Exposition d’une personne à l’inhalation de nanoparticules
La caractérisation de la pénétration des nanoparticules dans l’appareil respiratoire dépend de leur taille.
Toxicité : des données expérimentales pour mener des évaluations
Les données dont on dispose aujourd’hui sur la toxicité des nanoparticules proviennent en partie des études épidémiologiques et expérimentales sur les particules fines et ultra-fines de la pollution atmosphérique et des études expérimentales portant sur les nanoparticules manufacturées telles que les nanoparticules d’oxyde de titane, de noir de carbone, les nanotubes de carbone…
Les premières montrent une association entre les polluants sous forme particulaire présents dans l’air et les maladies pulmonaires telles que l’asthme et la bronchite chronique et cardiovasculaires. Toutefois, la plupart du temps, la composante nanométrique de la pollution atmosphérique n’a pas été spécifiquement mesurée et il n’est donc pas possible de séparer les effets spécifiquement liés aux particules plus grosses. Cependant les études expérimentales montrent clairement que les nanoparticules sont plus toxiques que les particules plus grosses de taille micrométriques pour la même composition. Ceci est clair pour les nanoparticules d’oxyde de titane et de noir de carbone. Pour les particules fines et ultrafines atmosphériques, la toxicité observée a été attribuée en partie aux contaminants adsorbés (collés) en surface de la particule.
De nombreuses études chez l’animal ont montré que la toxicité pulmonaire des nanoparticules était plus importante que celle observée avec la même quantité de particules de même nature mais plus grosses. Leur toxicité tient à leurs propriétés de surface ainsi qu’à leur taille et leur forme.
|
EXPLICATION : La disponibilité des informations : une préoccupation des agences de sécurité sanitaire
EXPLICATION : Les diverses formes des nanotubes de carbone
|
Crèmes et cosmétiques contenant des nanoparticules font l’objet de tests spécifiques avant leur mise sur le marché |
Quelle valeur donner aux résultats des tests menés sur le rat ?
Plusieurs études par inhalation chez le rat montrent que les nanoparticules ont la capacité de passer de l’épithélium nasal (la paroi interne du nez) au bulbe olfactif (zone du cerveau où sont analysées les odeurs captées par le nez). Par ailleurs, il n’est pas certain que ce que l’on observe chez le rat puisse s’appliquer à l’homme : les rats respirent par le nez uniquement, leur muqueuse nasale est olfactive à 50 % (contre 5 % chez l’homme) et le poids de leur bulbe olfactif est proportionnellement 177 fois plus élevé que chez l’homme. Néanmoins, une étude ancienne chez le singe a montré un passage de nanoparticules d’or (50 nm) par cette voie.
Toutefois, certains spécialistes discutent les conditions de réalisation de l’expérience.
| Rappel Quelques particularités des nanoparticules * Elles agissent par leur surface. Et, comme plus une matière est divisée, plus elle tend à être active, l’effet des nanoparticules dépend largement de la superficie de leur surface extérieure. * Leur forme joue un rôle : les premiers résultats montrent, par exemple, que les fibres sont plus nocives que les sphères car plus susceptibles d’effets mécaniques (piqûres) et plus difficiles à dégrader et à éliminer par l’organisme. * Elles peuvent très aisément transporter des substances collées (adsorbées) à leur surface. * Toutes ne sont pas solubles. Des premiers travaux suggèrent que leur taille les amène à suivre des « chemins » différents des particules microscopiques au sein de l’organisme (franchissement des barrières poumon sang, sang cerveau, placenta…) |
La majorité des études in vivo publiées à ce jour porte sur le rat, qui n’est pas toujours le modèle le plus pertinent pour l’exposition humaine, d’autant plus que la majorité des expériences ont été effectuées par instillation directe des substances par la trachée, ne reproduisant pas ainsi les conditions normales d’inhalation. La communauté scientifique n’est pas unanime à reconnaître la validité des résultats d’une étude montrant qu’une substance reconnue habituellement comme peu toxique, le dioxyde de titane, présente une toxicité pulmonaire plus importante lorsqu’elle est de dimension nanométrique.
Parmi les différents nanomatériaux, les chercheurs s’intéressent aux nanotubes de carbone dont certains présentent une similitude de forme avec les fibres minérales de type amiante. Il a été montré que les plus grands nanotubes mettaient plus de temps à être éliminés par les poumons. Toutefois, ce résultat est diversement accueilli car certains agglomérats évoqués par les études sont, chez l’homme, normalement filtrés par des dispositifs au niveau du nez (alors qu’ils ont été instillés et non inhalés par le rat lors de l’expérience).
Concernant les produits cosmétiques, l’Afssaps a mené une enquête auprès des industriels de la cosmétique en 2008. Il ressort des réponses obtenues que les produits cosmétiques sont susceptibles de renfermer notamment des nanoparticules insolubles et/ou biopersistantes telles que les dioxydes de titane et de fer et des oxydes de zinc, d’argent et d’or. Toutes les catégories de produits (crèmes, gels, lotions, savons…) peuvent contenir des nanoparticules. Concernant l’évaluation des risques, l’Afssaps insiste sur le fait que les outils analytiques appropriés sont insuffisamment pertinents pour quantifier ces nanoparticules et mesurer leur biodégradabilité. De plus, l’interdiction de l’expérimentation animale sur les produits finis et sur les ingrédients est effective depuis mars 2009 (7e amendement de la directive 76/768/CEE) bien qu’il n’existe actuellement aucune méthode d’essai in vitro validée pour évaluer la toxicité à long terme des nanomatériaux. De même, la littérature disponible ne permet pas d’exclure un passage, aussi faible soit-il, des particules dans la peau viable. L’Afssaps s’interroge sur le devenir des nanoparticules en cas d’accumulation dans les follicules pileux et sur le risque lié aux applications sur une peau lésée.
Seules quelques études ont abordé la toxicité des nanoparticules après ingestion orale. Les résultats sont souvent discordants et ne permettent pas de conclure à un effet dose, à un effet taille, à une relation entre les caractéristiques physico-chimiques de la particule et la toxicité. C’est pourquoi toute évaluation de nanomatériau devra être conduite au cas par cas, en prenant en considération ses propriétés spécifiques, différentes de celles du matériau conventionnel correspondant.
De manière générale, la toxicité des nanoparticules sur l’ensemble de l’organisme (systémique) est encore insuffisamment explorée.
Par ailleurs, concernant les risques de cancer, les données liées aux nanomatériaux manufacturés sont encore peu nombreuses. Les premiers résultats concernant les fullerènes et le dioxyde de titane sont contradictoires. Plusieurs études in vitro suggèrent un potentiel carcinogène de ces deux substances sous l’action des UV mais aucune augmentation de l’incidence de cancers n’a été mise en évidence in vivo. Plusieurs études sont parues en 2008, notamment sur la capacité des nanotubes à induire des tumeurs pulmonaires chez les rongeurs. Une similitude d’action a été avancée pour certains nanotubes (plutôt longs et rigides) et l’amiante. Toutefois, là encore, les conditions de l’expérience (doses et mode d’administration) ne permettent pas, selon quelques spécialistes, de conclure à un risque cancérogène chez l’homme.
En conclusion, il apparaît qu’il ne suffit pas de considérer l’espèce chimique des nanoparticules (en quoi sont-elles faites ?) et la concentration maximum admissible (combien de milligrammes par mètre cube pour obtenir tel effet négatif ?) comme on le fait habituellement dans les études de toxicité. Les travaux à mener doivent permettre de comprendre leur devenir une fois qu’elles ont pénétré dans l’organisme, les réactions qu’elles provoquent, la manière dont elles sont éliminées ou non.
Il n’est donc pas possible aujourd’hui de mener une évaluation pertinente des risques sanitaires potentiels liés aux nanoparticules manufacturées pour la population en général. Comparativement aux substances chimiques conventionnelles, les données épidémiologiques et toxicologiques valides tout comme les caractéristiques des expositions des populations ne peuvent être générées du fait de méthodes et d’outils de mesure adaptés encore insuffisants.

 (4006 ko)
(4006 ko)